在化学的学习中,大家有没有想过这样的问题:为什么水可以溶解盐?为什么油不溶于水?为什么有些物质沸点高、有些低?这些现象的背后,往往都与一个关键的概念有关——分子间作用力。

一、什么是分子间作用力?
分子间作用力,顾名思义,是分子与分子之间的静电吸引。它不同于分子内部的共价键或离子键那种强烈的“化学键”,但它对物质的状态、熔沸点、溶解性、黏度、表面张力等物理性质却有着不可忽视的影响。
简单来说,分子间作用力决定了“分子们靠得有多近、粘得有多牢”。
二、分子间作用力有哪几种?
1.范德华力
范德华力很弱,比化学键的能量少1-2个数量级,但是所有的分子之间都存在范德华力。
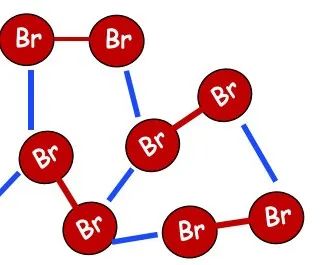
相对分子量越大,范德华力越大;分子极性越大范德华力越大。
2.氢键
是一种特殊且较强的分子间作用力,发生在已经与F、O、N这三种高电负性原子形成共价键的氢原子与另外的F、O、N等电负性很大的原子之间。比如水、氨、氟化氢等常见物质都能形成氢键。
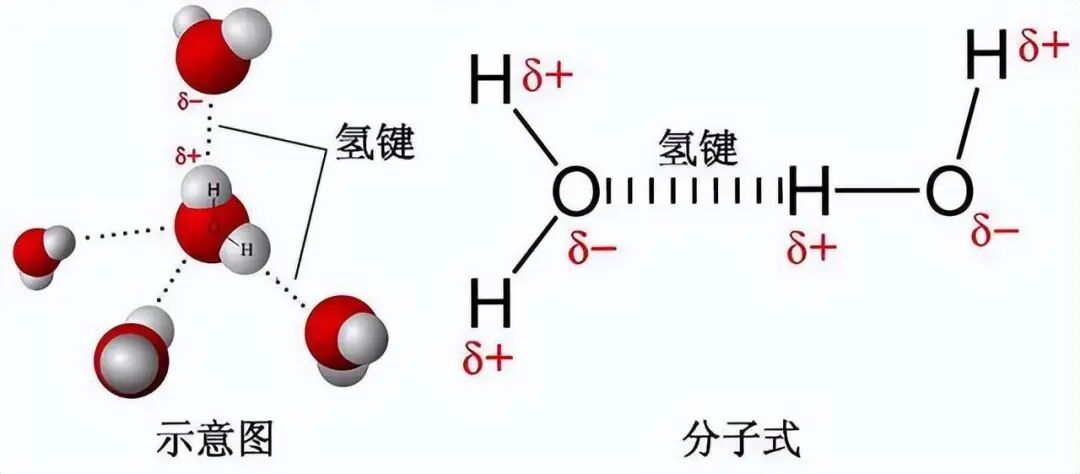
氢键是一种能量低于化学键但是高于范德华力的分子间作用力。氢键既存在于分子之间也存在于分子内部。
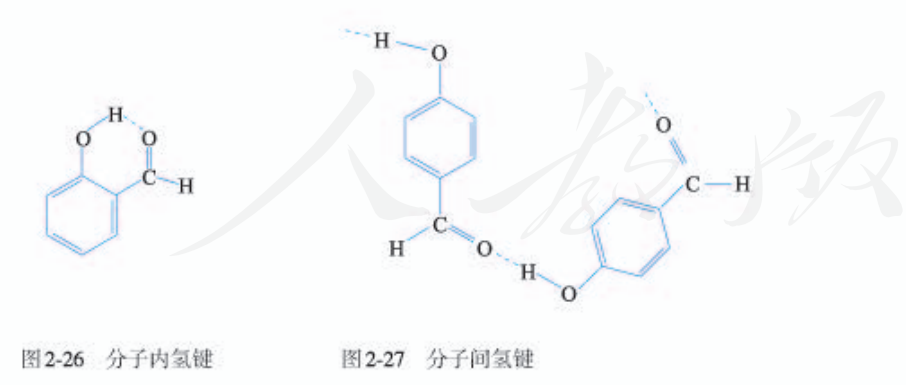
三、分子间作用力对物质性质的影响
分子间作用力主要影响物质的物理性质,比如熔沸点,溶解性,黏度,蒸气压等。

分子间作用力实际上是分子之间的吸引力,因此分子间作用力越大,几个分子越不容易被拉开,因此会导致物质的熔沸点越高,黏度越大,饱和蒸气压越低。
实际上生活中很多现象是因为分子之间的作用力在起作用,比如为什么水可以溶解盐?为什么油不溶于水?为什么会有毛细现象?为什么水冻成冰后体积会增加?
文章来源:
Joy的化学魔咒
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢